- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:50.
- E modifikuara e fundit 2025-06-01 07:37.
Dallimi kryesor midis acidit karbonik dhe bikarbonatit është se acidi karbonik është një përbërje kimike neutrale, ndërsa bikarbonati është një përbërje kimike e ngarkuar negativisht.
Acidi karbonik është një acid i dobët që formohet në tretësirë kur dioksidi i karbonit tretet në ujë, me formulën kimike H2CO3. Bikarbonati formohet nga kombinimi i tre atomeve të oksigjenit, një atomi hidrogjeni dhe një atomi karboni me formulën kimike HCO3-.
Çfarë është Acidi Karbonik?
Acidi karbonik është H2CO3. Ndonjëherë, ne i japim këtë emër solucioneve që kanë dioksid karboni të tretur në ujë ose ujë të gazuar. Kjo është për shkak se uji i gazuar përmban një sasi të vogël të H2CO3. Për më tepër, acidi karbonik është një acid i dobët dhe mund të formojë dy lloje kripërash si karbonate dhe bikarbonate. Masa molare e këtij përbërësi është 62,024 g/mol.
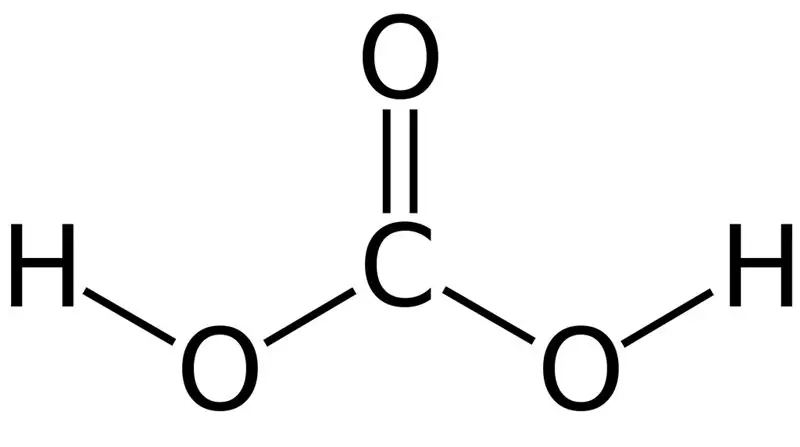
Figura 01: Struktura kimike e acidit karbonik
Kur dioksidi i karbonit tretet në ujë, ai hyn në një ekuilibër midis dioksidit të karbonit dhe acidit karbonik. Ekuilibri është si më poshtë:
CO2 + H2O ⟷ H2CO3
Nëse i shtojmë një tepricë acidi karbonik në një bazë, ai jep bikarbonat. Por, nëse ka një tepricë të bazës, atëherë acidi karbonik tenton të japë kripëra të gazuara. Më saktësisht, acidi karbonik është një përbërje e acidit karboksilik që ka dy zëvendësues të grupit hidroksil të lidhur me karbonin karbonil. Për më tepër, është një acid poliprotik, i cili është i aftë të dhurojë protone. Ai ka dy protone të lëvizshëm, kështu që është veçanërisht diprotik.
Çfarë është bikarbonati?
Bikarbonati formohet nga kombinimi i tre atomeve të oksigjenit, një atomi hidrogjeni dhe një atomi karboni. Produkti i këtij kombinimi mund të jetë një jon ose një përbërje me më shumë elektrone se protone. Ne mund ta përshkruajmë atë si një specie kimike që ka formulën kimike HCO3-.
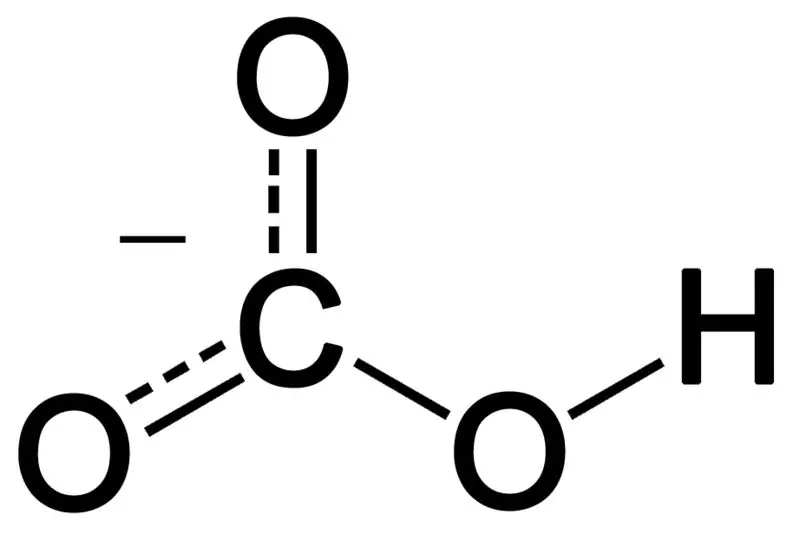
Figura 02: Struktura kimike e anionit bikarbonat
Ky përbërës është një pjesë thelbësore e sistemit tampon pH të trupit, në terma laikë: është përgjegjës për mbajtjen e gjakut në një gjendje që nuk është shumë acid ose shumë bazë. Përveç kësaj, shërben si një mënyrë për të mbajtur nën kontroll lëngjet e tretjes pasi stomaku të ketë mbaruar tretjen e ushqimit. Për më tepër, acidi karbonik në ujin e shiut formon jone bikarbonate kur godet shkëmbinjtë. Kjo rrjedhë e joneve bikarbonate është e rëndësishme në mbajtjen e ciklit të karbonit.
Cili është ndryshimi midis acidit karbonik dhe bikarbonatit?
Acidi karbonik është një acid i dobët që formohet në tretësirë kur dioksidi i karbonit tretet në ujë, dhe formula e tij kimike është H2CO3. Bikarbonati formohet nga kombinimi i tre atomeve të oksigjenit, një atomi hidrogjeni dhe një atomi karboni me formulën kimike HCO3-. Dallimi kryesor midis acidit karbonik dhe bikarbonatit është se acidi karbonik është një përbërës kimik neutral, ndërsa bikarbonati është një përbërës kimik i ngarkuar negativisht. Për më tepër, acidi karbonik përdoret në prodhimin e pijeve me flluska, me gaz, trajtimin e dermatiteve, në shpëlarjen e gojës, etj., ndërsa bikarbonati përdoret në përgatitjet ushqimore si pjekja (si thartës) dhe jep aftësinë për t'i rezistuar ndryshimeve të pH.
Infografia e mëposhtme përmbledh ndryshimin midis acidit karbonik dhe bikarbonatit në formë tabelare për krahasim krah për krah.
Përmbledhje - Acidi karbonik kundër bikarbonatit
Acidi karbonik është H2CO3. Bikarbonati formohet nga kombinimi i tre atomeve të oksigjenit, një atomi hidrogjeni dhe një atomi karboni, me formulën kimike HCO3-. Dallimi kryesor midis acidit karbonik dhe bikarbonatit është se acidi karbonik është një përbërje kimike neutrale, ndërsa bikarbonati është një përbërje kimike e ngarkuar negativisht.






