- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:50.
- E modifikuara e fundit 2025-06-01 07:37.
Dallimi kryesor - Ligand i fortë vs Ligand i dobët
Një ligand është një atom, jon ose një molekulë që dhuron ose ndan dy nga elektronet e tij nëpërmjet një lidhjeje kovalente koordinative me një atom ose jon qendror. Koncepti i ligandëve diskutohet nën kiminë e koordinimit. Ligandët janë specie kimike që përfshihen në formimin e komplekseve me jonet metalike. Prandaj, ato njihen edhe si agjentë komplekse. Ligandët mund të jenë monodentë, bidentë, tridentat, etj në bazë të denticitetit të ligandit. Denticiteti është numri i grupeve të donatorëve të pranishëm në një ligand. Monodentat do të thotë që ligandi ka vetëm një grup donatorësh. Bidentate do të thotë se ka dy grupe donatorësh për një molekulë ligandi. Ekzistojnë dy lloje kryesore të ligandëve të kategorizuar bazuar në teorinë e fushës kristalore; ligandë të fortë (ose ligandë të fortë në terren) dhe ligandë të dobët (ose ligandë të dobët të fushës). Dallimi kryesor midis ligandëve të fortë dhe ligandëve të dobët është se ndarja e orbitaleve pas lidhjes me një ligand të fushës së fortë shkakton një ndryshim më të lartë midis orbitaleve të nivelit më të lartë dhe më të ulët të energjisë ndërsa ndarja e orbitaleve pas lidhjes me një ligand të fushës së dobët shkakton një ndryshim më të ulët. ndërmjet orbitaleve të nivelit më të lartë dhe më të ulët të energjisë.
Çfarë është Teoria e Fushës Kristal?
Teoria e fushës së kristaleve mund të përshkruhet si një model që është krijuar për të shpjeguar thyerjen e degjenerimeve (predha elektronike me energji të barabartë) të orbitaleve elektronike (zakonisht orbitalet d ose f) për shkak të fushës elektrike statike të prodhuar nga një mjedis përreth. anion ose anione (ose ligande). Kjo teori përdoret shpesh për të demonstruar sjelljen e komplekseve të joneve të metaleve në tranzicion. Kjo teori mund të shpjegojë vetitë magnetike, ngjyrat e komplekseve të koordinimit, entalpitë e hidratimit, etj.
Teori:
Ndërveprimi midis jonit metalik dhe ligandëve është rezultat i tërheqjes midis jonit metalik me ngarkesë pozitive dhe ngarkesës negative të elektroneve të paçiftuara të ligandit. Kjo teori bazohet kryesisht në ndryshimet që ndodhin në pesë orbitale të elektroneve të degjeneruara (një atom metali ka pesë orbitale d). Kur një ligand i afrohet jonit metalik, elektronet e paçiftuara janë më afër disa orbitaleve d sesa ato të d orbitaleve të tjera të jonit metalik. Kjo shkakton një humbje të degjenerimit. Dhe gjithashtu, elektronet në orbitalet d i sprapsin elektronet e ligandit (sepse të dyja janë të ngarkuara negative). Prandaj orbitalet d që janë më afër ligandit kanë energji të lartë se ajo e orbitaleve të tjera d. Kjo rezulton në ndarjen e orbitaleve d në orbitale d me energji të lartë dhe orbitale d me energji të ulët, bazuar në energjinë.
Disa faktorë që ndikojnë në këtë ndarje janë; natyra e jonit metalik, gjendja e oksidimit të jonit metalik, rregullimi i ligandëve rreth jonit metalik qendror dhe natyra e ligandëve. Pas ndarjes së këtyre d orbitaleve në bazë të energjisë, diferenca ndërmjet orbitaleve d me energji të lartë dhe të ulët njihet si një parametër i ndarjes së fushës kristal (∆tetor për komplekset oktaedrale).
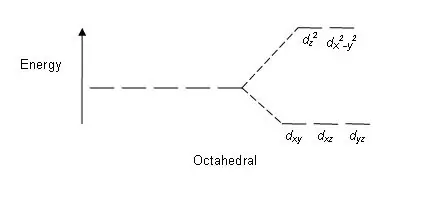
Figura 01: Modeli i ndarjes në komplekset oktaedrale
Modeli i ndarjes: Meqenëse ka pesë d orbitale, ndarja ndodh në një raport 2:3. Në komplekset oktaedrale, dy orbitale janë në nivelin e lartë të energjisë (të njohura kolektivisht si 'p.sh.'), dhe tre orbitale janë në nivelin më të ulët të energjisë (të njohura kolektivisht si t2g). Në komplekset tetraedrale ndodh e kundërta; tre orbitale janë në nivelin më të lartë të energjisë dhe dy në nivelin më të ulët të energjisë.
Çfarë është Ligandi i Fortë?
Një ligand i fortë ose një ligand i fortë në terren është një ligand që mund të rezultojë në një ndarje më të lartë të fushës kristalore. Kjo do të thotë, lidhja e një ligandi të fortë në terren shkakton një ndryshim më të madh midis orbitaleve të nivelit më të lartë dhe më të ulët të energjisë. Shembujt përfshijnë CN- (ligandë cianide), JO2-- (nitroligand) dhe CO (karbonil ligandët).
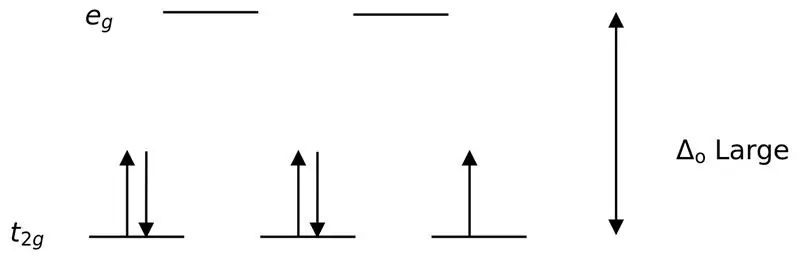
Figura 02: Ndarje me rrotullim të ulët
Në formimin e komplekseve me këta ligandë, në fillim, orbitalet me energji më të ulët (t2g) mbushen plotësisht me elektrone përpara se të mbushen në çdo orbital tjetër të nivelit të lartë të energjisë (p.sh.). Komplekset e formuara në këtë mënyrë quhen "komplekse me rrotullim të ulët".
Çfarë është Ligandi i dobët?
Një ligand i dobët ose një ligand i dobët i fushës është një ligand që mund të rezultojë në një ndarje më të ulët të fushës së kristalit. Kjo do të thotë, lidhja e një ligandi të fushës së dobët shkakton një ndryshim më të ulët midis orbitaleve të nivelit më të lartë dhe më të ulët të energjisë.
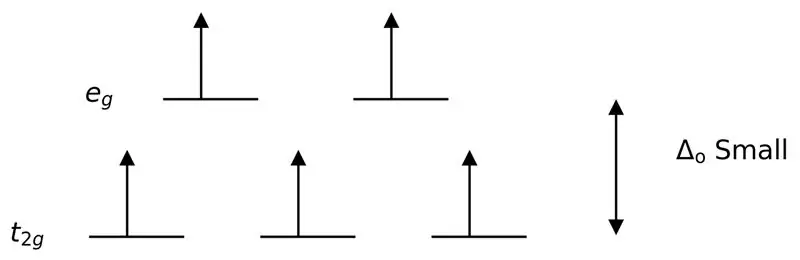
Figura 3: Ndarja me rrotullim të lartë
Në këtë rast, meqenëse diferenca e ulët midis dy niveleve orbitale shkakton zmbrapsje midis elektroneve në ato nivele të energjisë, orbitalet me energji më të lartë mund të mbushen lehtësisht me elektrone kur krahasohen me ato në orbitalet me energji të ulët. Komplekset e formuara me këta ligandë quhen "komplekse me rrotullim të lartë". Shembuj të ligandëve të fushës së dobët përfshijnë I- (ligand jodid), Br- (ligand bromid), etj.
Cili është ndryshimi midis Ligandit të fortë dhe Ligandit të dobët?
Ligand i fortë vs Ligand i dobët |
|
| Një ligand i fortë ose një ligand i fortë në terren është një ligand që mund të rezultojë në një ndarje më të lartë të fushës kristalore. | Një ligand i dobët ose një ligand i dobët në terren është një ligand që mund të rezultojë në një ndarje më të ulët të fushës kristalore. |
| Teori | |
| Ndarja pas lidhjes së një ligandi të fortë në terren shkakton një ndryshim më të madh midis orbitaleve të nivelit më të lartë dhe më të ulët të energjisë. | Ndarja e orbitaleve pas lidhjes së një ligandi me fushë të dobët shkakton një diferencë më të ulët midis orbitaleve të nivelit më të lartë dhe më të ulët të energjisë. |
| Kategoria | |
| Komplekset e formuara me ligandë të fortë në terren quhen "komplekse të rrotullimit të ulët". | Komplekset e formuara me ligandë në terren të dobët quhen "komplekse me rrotullim të lartë". |
Përmbledhje - Ligand i fortë vs Ligand i dobët
Ligandët e fortë dhe ligandët e dobët janë anione ose molekula që shkaktojnë ndarjen e d orbitaleve të një joni metalik në dy nivele energjie. Dallimi midis ligandëve të fortë dhe ligandëve të dobët është se ndarja pas lidhjes së një ligandi të fushës së fortë shkakton një diferencë më të lartë midis orbitaleve të nivelit më të lartë dhe më të ulët të energjisë ndërsa ndarja e orbitaleve pas lidhjes së një ligandi të fushës së dobët shkakton një ndryshim më të ulët midis orbitaleve më të larta dhe më të ulëta. orbitalet e nivelit të energjisë.






