- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:50.
- E modifikuara e fundit 2025-06-01 07:37.
Dallimi kryesor midis monoksidit të azotit dhe pentoksidit të dinitrogjenit është se monoksidi i azotit është një gaz i pangjyrë ndërsa pentoksidi i dintrogjenit është një solid i bardhë.
Monoksidi i azotit dhe pentoksidi i dinitrogjenit janë komponime kimike që përmbajnë azot dhe oksigjen. Këto janë okside të azotit. Megjithatë, ato kanë veti të ndryshme kimike dhe fizike.
Çfarë është monoksidi i azotit?
Monoksidi i azotit është një përbërës inorganik që ka formulën kimike NR. Ne e quajmë atë oksid nitrik pasi është një oksid azoti. Në fakt është një radikal i lirë sepse ka një elektron të paçiftuar. Për më tepër, është një molekulë diatomike heteronukleare.
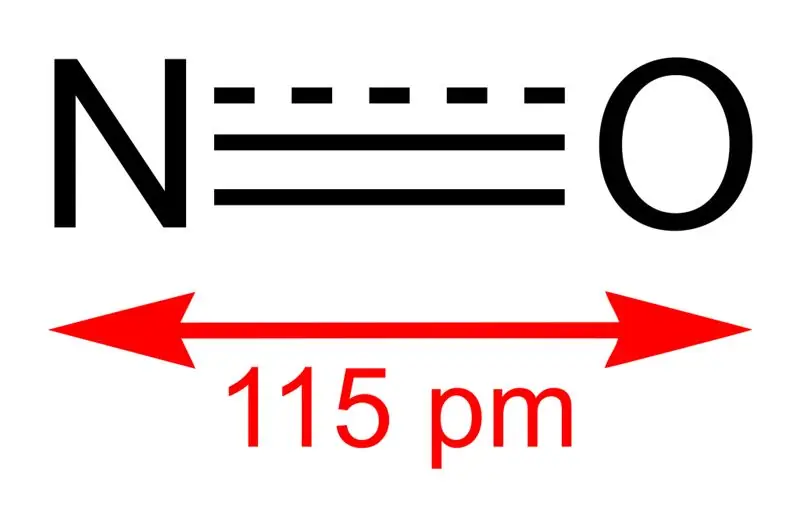
Figura 01: Struktura e monoksidit të azotit dhe gjatësia e lidhjes ndërmjet N dhe O
Masa molare e këtij përbërësi është 30 g/mol. Shfaqet si gaz pa ngjyrë. Për më tepër, pika e tij e shkrirjes është -164 °C ndërsa pika e vlimit është -152 °C, të cilat janë vlera shumë të vogla kur krahasohen me ato të oksideve të tjera të azotit. Ne mund ta prodhojmë këtë radikal të lirë nëpërmjet oksidimit të amoniakut në 850 °C në prani të një katalizatori platini. Megjithatë, në shkallë laboratorike mund ta përgatisim duke reduktuar acidin nitrik të holluar me bakër.
Çfarë është Dinitrogen Pentoxide?
Pentoksidi i dinitrogjenit është një përbërës inorganik që ka formulën kimike N2O5 Ne e quajmë atë pentoksid azoti. Është një oksid binar i azotit. Për më tepër, është i paqëndrueshëm dhe mund të veprojë si një oksidues i rrezikshëm. Masa molare e përbërjes është 108.01 g/mol. Ndodh në një ngjyrë të bardhë të fortë.
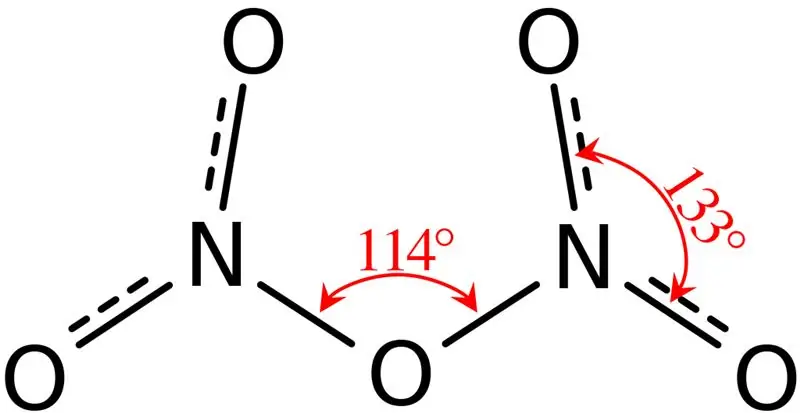
Figura 02: Struktura e Pentoksidit Dinitrogjen
Për më tepër, pika e shkrirjes së këtij përbërësi është 41 °C dhe, në 47 °C kjo përbërje i nënshtrohet sublimimit. Ky përbërës reagon me ujin, duke dhënë acid nitrik. Për më tepër, forma molekulare e molekulës së pentoksidit të ditrogjenit është e rrafshët. Ne mund ta prodhojmë këtë përbërje nëpërmjet dehidrimit të acidit nitrik me pentoksid fosfori.
Cili është ndryshimi midis monoksidit të azotit dhe pentoksidit të dinitrogjenit?
Monoksidi i azotit është një përbërës inorganik që ka formulën kimike JO ndërsa pentoksidi i dinitrogjenit është një përbërës inorganik që ka formulën kimike N2O5 Dallimi kryesor midis monoksidit të azotit dhe pentoksidit të dinitrogjenit është se monoksidi i azotit është një gaz i pangjyrë ndërsa pentoksidi i dinitrogjenit është një solid i bardhë. Për më tepër, ne mund të prodhojmë monoksid azoti nëpërmjet oksidimit të amoniakut në 850 °C në prani të një katalizatori platini. Sidoqoftë, prodhimi i pentoksidit të dizogjenit bëhet përmes dehidrimit të acidit nitrik me pentoksid fosfori. Kur merret parasysh forma molekulare, monoksidi i azotit është linear ndërsa pentoksidi i dintrogjenit është planar.
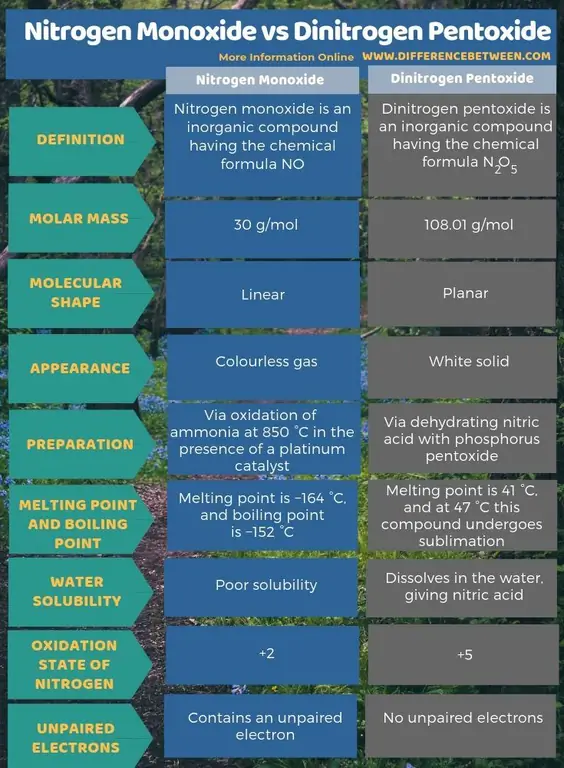
Përmbledhje - Monoksidi i azotit kundrejt Pentoksidit të Dinitrogjenit
Monoksidi i azotit është një përbërës inorganik që ka formulën kimike JO ndërsa pentoksidi i dinitrogjenit është një përbërës inorganik që ka formulën kimike N2O5 Dallimi kryesor midis monoksidit të azotit dhe pentoksidit të dinitorit është se monoksidi i azotit është një gaz i pangjyrë ndërsa pentoksidi i dinitrogjenit është një solid i bardhë.






